 電話:
電話:
0755-86000169
0755-26418142
 手機:
手機:
18565807701
 郵箱:
郵箱:
info@enco-bio.com
 地址:
地址:
深圳市南山區桃源街道平山社區留仙大道4093號南山云谷創新產業園南風樓A座207
行業新聞
數字PCR是將PCR反應分成許多單元,每個單元中都包含離散數量的靶基因拷貝(0,1,2,3 ,……)。數字PCR這項強大的技術,使得核酸定量,基因型檢測等應用的檢測限更低,檢測結果更加準確。本文從分區的優點和泊松統計開始,包括誤差的來源方面,探討一下數字PCR的數學原理。我們討論比較五種商品化的數字PCR儀器,主要分為芯片型(cdPCR)和液滴型(ddPCR)的兩種,并對市面上主流的數字PCR參數進行了比較。
1. 數字分析檢測和模擬分析檢測
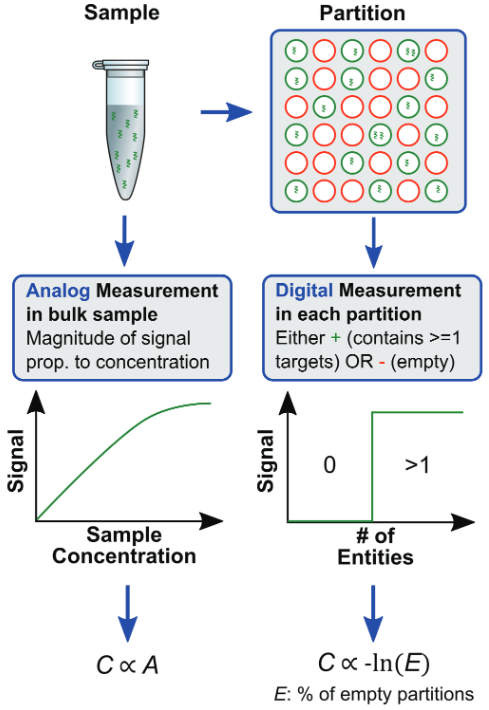
圖1. 模擬分析檢測(實時熒光定量PCR)和數字分析檢測(數字PCR)的比較
模擬分析檢測是在反應體系中檢測與總體核酸樣品濃度C成正比的讀出信號A。通常使用熒光方法進行檢測,例如使用標記的探針,檢測熒光信號,從而定量靶基因的核酸拷貝數。數字分析檢測是首先將樣品分到多個單元中,每個單元的都包含離散數量的靶基因拷貝(0,1,2,3 ,……),每個單元都被獨立檢測,檢測結果為0(陰性)或1(陽性),標示獨立單元中是否存在靶基因拷貝。利用泊松分布統計,檢測陰性單元的比例,就能夠計算出原始樣品中靶基因的拷貝數。
數字PCR的概念來源于計算機系統,計算機中的數字回路提供二進制輸出。數字信號在計算和通信領域被廣泛應用,信息被編碼為一系列0和1。數字信號的優點是降低了檢測元素的負擔,每個元素只需要區分兩種信號:陰性和陽性。在數字PCR中,儀器只需要分辨陰陽性的區別就可以了,然后通過泊松分布的統計方式,可以得知陰性單元的比例與樣品中的靶基因拷貝數相關。
2. 分區的優點
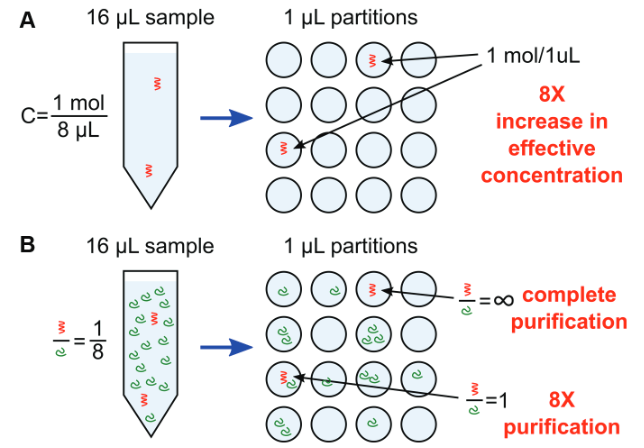
圖2. 數字PCR進行分區的好處:A. 增加靶基因的有效濃度,B. 富集效果,降低背景干擾。
隨著分區后,單元數量的增加和單元體積的減少,能夠體現出三個明顯的好處。
第一個好處是:顯著降低檢測限(LOD:Limit of detection)。因為分區單元的體積越小,每個單元中靶基因拷貝的濃度越高。這種特性使得數字PCR能夠進行微量的核酸檢測,或者檢測分泌到細胞外環境的核酸。
第二個好處是:分區后,每個單元的富集作用能夠有效改善復雜混合物檢測結果。具體的說數字PCR方法提升了感興趣靶點的信號,拉開了與背景信號的比值。以圖2B為例,在數字PCR反應體系中,一個分區單元中實現了8倍純化,另一個分區單元中實現了完全純化。數字PCR的富積效應有效實現了低豐度核酸對野生型背景的擴增效率,對于癌癥診斷等應用非常有用。分區數量的越多,數字PCR的富集作用越強。
第三個好處是:數字PCR在計算靶基因拷貝數時,相比實時熒光定量PCR能夠提供更加出色檢測精度和線性。因為數字PCR檢測的是PCR體系中的單個靶基因分子,而不是靶基因在反應體系中的整體濃度。數字PCR檢測精度隨著分區數量提高而提高;分區數量的增加也會擴展動態范圍,提升被檢測樣品的濃度范圍。
3. 分區的方法:物理隔室和微滴
目前主流的數字PCR系統主要使用兩種方式實現PCR反應體系的分區:1)使用物理的腔室或小孔陣列,2) 使用微滴乳液方式,在連續的油相中分隔水相(PCR反應體系)。通過這兩種方式,實現不同的分區單元的體積。
腔室陣列也稱為芯片式數字PCR,通過使用光刻工藝和微細加工工藝實現腔室小型化。例如,光刻和硅蝕刻工藝已被用于制造50,000個用于數字酶聯免疫吸附測定(ELISA)的孔,每個孔的體積為50fL。用于執行數字酶分析的類似平臺,孔設計為可容納1.4 fL也可以通過在1μm的硅結構上微成型柔性彈性體(PDMS)來制造。腔室陣列也可以使用微成型或壓印光刻技術在塑料中制備,以及使用軟光刻的變體在其他材料中制成。生產過程的再溶解決定了體積的可變性。使用光刻技術,公差可以小至數百納米,而使用納米級壓印光刻技術,公差可以小于25 nm。分區單元的體積可變性會導致數字計數分析的不確定性,這個我們下一節再說。
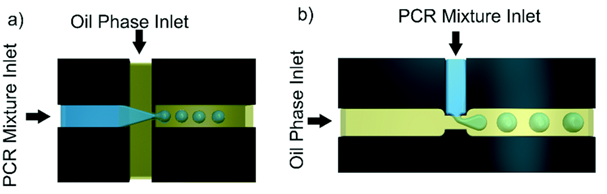
圖3. 微滴式數字PCR微流控示意圖,a)液流與油流十字交叉結構,b)液流與油流T型接頭結構。
第二種分配方法是利用油中的液滴乳液(微滴式數字PCR)。通過使用微流控T型接頭制備單分散液滴,其中水流與油流結合,或者通過液流聚焦交叉幾何結構將水流與兩條正交油流結合。更先進的方式是通過約束梯度來生成微滴,通過將液流通過一個固定角度的斜坡,不依賴流體流動的生成液滴,液滴的大小更加穩定。微滴式數字PCR中的油相是非反應性的,對水相成分溶解度很低,防止PCR反應物在微滴單元之間擴散;通常選擇碳氟化合物油。穩定的液滴生成需要添加表面活性劑來穩定水油界面并防止液滴聚結。必須對表面活性劑進行優化,使其不干擾檢測,并防止小生物分子擴散到油中。
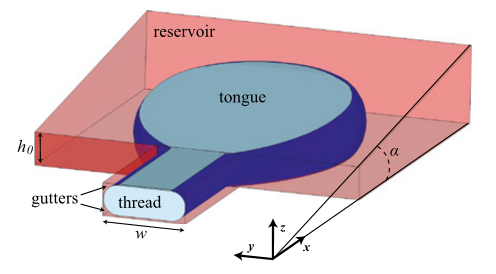
圖3. 基于約束梯度生成微滴的結構草圖,水相(藍色)通過路口通道進入裝滿油相(橙色)的儲液器中,儲液器的頂部傾斜了一個角度α。水相進入油相后,通過固定角度的斜坡,不需要流動的油相,形成大小均一的微滴。
通常來說,芯片式數字PCR的物理腔室的體積差異的分散度<3%,微滴式數字PCR的微滴體積差異分散度<5%,但是基于約束梯度生成微滴的方式生成的微滴,微滴的體積差異小于芯片式數字PCR,體積差異分散度可低至0.1%,是目前最先進的微滴生成方式。芯片式數字PCR在物理腔室的內壁上需要涂抹封閉劑(例如,牛血清白蛋白),防止生物分子被腔室壁吸附和防止PCR反應酶失活。微滴式數字PCR需要使用兩性親和表面活性劑(例如,聚乙二醇)來穩定水油界面。
4. 分區的統計學原理
在數字PCR系統中,分區統計能夠確定樣品中靶基因拷貝濃度和置信區間。分區操作類似我們在實驗室中分裝樣品,但是實驗室中分裝樣品時,由于每個分裝數量較少,每個單元中包含有大量樣品,體現不出樣品的統計學差異。在數字PCR系統中,需要將PCR體系分區為數以萬計的單元;這時就無法忽視統計學差異了。在數字PCR系統中,反應體系中總的靶基因拷貝數(m),m的數量級總是小于分區單元的總數量(n)的數量級,單個分區單元中平均包含(λ)個靶基因拷貝,通過λ的數值可計算樣品中靶基因拷貝的濃度。
![]()
公式1. λ是每個分區單元中的平均靶基因拷貝數,m是反應體系中總的靶基因拷貝數,n是分區單元的總數,C是靶基因拷貝在PCR反應體系的濃度,Vd是分區單元的體積。
每個分區的單元中實際包含的靶基因拷貝數量是離散的(例如,0,1,2,3,……),那么分區中包含k個靶基因拷貝數的概率服從泊松分布(Poisson Distribution)。
![]()
公式2. 泊松分布的公式
泊松分布的均值和反差均等于λ,μ = σ2 = λ,陰性分區的單元的概率為p(0)= e-λ,因此,靶基因拷貝數(m)和樣品濃度C可以很容易地從陰性分區單元的百分比(E)推導出來。
![]()
![]()
![]()
公式3. 樣品濃度C和靶基因拷貝數m推導過程
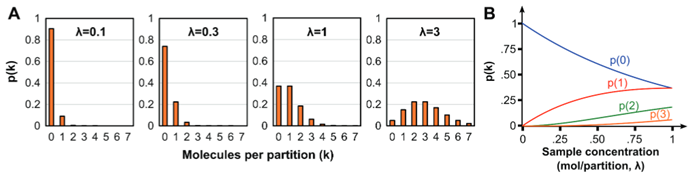
圖4. 泊松分布統計信息。 (A)對于各種樣本濃度λ,一個分區單元包含k個拷貝的概率。 (B)對于各種樣品濃度λ,每個分區單元分別為0,1,2和3個拷貝的概率。 A和B均使用泊松分布進行計算。
5. 數字PCR的誤差來源
在常規的模擬分析檢測(realtime-PCR)中,測量不確定度通常受檢測儀器的分辨率限制,例如,熒光檢測器能夠分辨發射熒光的微小差異。 在像數字PCR這樣的數字化檢測中,檢測系統僅需識別一個分區單元是0還是> 1(陰性還是陽性),這使得數字PCR對檢測器或檢測過程化學性質的依賴性降低,對于PCR反應的抑制劑不敏感。數字PCR有兩個誤差來源:采樣誤差和分配誤差。采樣誤差設定了低濃度下檢測限的下限,與儀器無關,而分配誤差在高濃度下占主導地位,取決于儀器的采樣與分區性能。
采樣誤差是任何生物檢測都會出現的子樣本誤差,由于采樣并不能分析所有的樣品體積,只能分析其中的一個子樣品,從而倒置重復測試之間的統計差異。例如,像血清這樣的診斷樣品可能有5ml,但是我們只能取其中20μl樣品進行檢測。這個采樣的過程引入一個不可避免的誤差,特別是當原始樣品中需要被檢測的靶基因拷貝數很少時。當對于較大樣品的一部分進行采樣時,每個樣本中靶基因拷貝數標準偏差為![]() ,m是分區單元中預期的靶基因拷貝數,基于標準化測量的不確定度計算如下:對于95%置信區間(CI),Zc為1.96。
,m是分區單元中預期的靶基因拷貝數,基于標準化測量的不確定度計算如下:對于95%置信區間(CI),Zc為1.96。
![]()
分配誤差,這個是只有數字PCR系統才有的誤差,因為同一個實驗中靶基因的拷貝分布可能每次都不同。陰性分區單元的百分比(E)的標準誤差為![]() ,基于標準化測量的不確定度計算如下:
,基于標準化測量的不確定度計算如下:
![]()
分配誤差在靶基因拷貝濃度特別高(λ數值大)的時候和靶基因拷貝濃度特別低(λ數值小)的時候非常顯著,靶基因濃度高的時候,幾乎沒有陰性分區單元(E趨近于0);靶基因濃度特別低的時候,則幾乎全部都是陰性分區單元(E趨近于1)。在低濃度下,分配誤差包含采樣誤差,因為兩個誤差都基于二項式分布和泊松分布的相同概念。在實踐中,我們可以通過重復實驗,降低實驗帶來的不確定度。
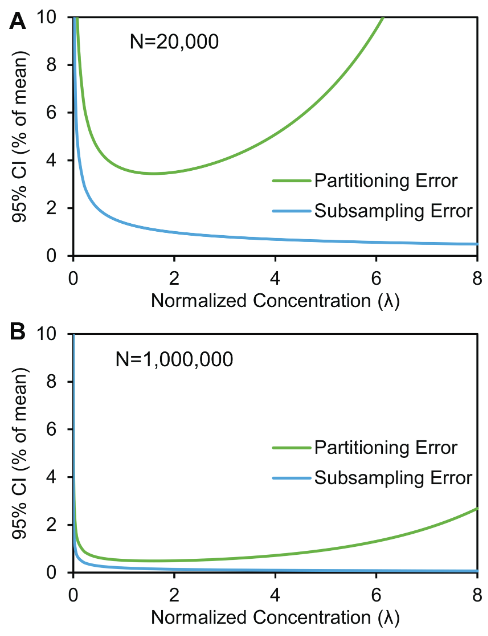
假設A系統產生2萬個微滴和B系統產生100萬個微滴,則數字PCR檢測中的采樣誤差和分區誤差在不同濃度中的數值曲線。
圖5比較了在2萬個微滴和100萬個微滴的情況下,采樣誤差和分配誤差帶來的影響。在λ數值很大的情況下,分配誤差限制了可以檢測的最大濃度;在λ數值很小的情況下,兩種誤差都會增加。可以看到,在微滴數量越多,在相同λ數值下,誤差越小,說明了分區數量越多,儀器誤差越小的數學基礎。
泊松分布的數學基礎是假設所有的分區單元體積和PCR反應條件都保持完全一致,沒有考慮分配體積變化產生的影響,微滴體積的不一致會扭曲靶基因拷貝的分布。因此實際誤差會包含微滴體積的不確定度影響。將體積不確定度定義為![]() ,結合分配誤差,可以得到
,結合分配誤差,可以得到
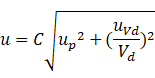
實際上微滴體積的不一致性還是挺重要的,實驗的重復性產生的誤差條主要受到體積不確定性的影響,基于約束梯度生成微滴原理的數字PCR儀器,能夠獲得最好的重復性。
6. 數字PCR系統的介紹
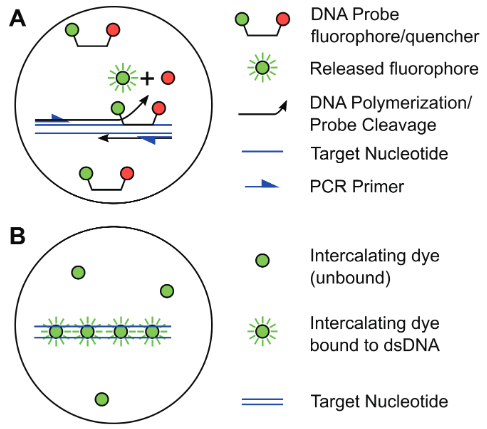
圖6. 數字PCR中的擴增和檢測化學(與實時熒光定量PCR相同)。 (A)水解探針(例如Taqman)。 (B)DNA結合探針(例如Evagreen)
數字PCR的檢測原理與熒光定量PCR相同,只是在定量方式上有所不同。數字PCR反應體系中包含目標DNA,PCR試劑和熒光標記物,在熱循環儀上進行PCR反應,在循環結束后,終點檢測每個分區單元中的熒光信號。熒光標記物為水解探針(探針法如,Taqman)或嵌入DNA的結合燃料(染料法如,Evagreen)。使用終點法檢測,PCR循環數通常>30,即使微滴中只含有1個靶基因拷貝也能被檢測到,與擴增效率無關。通過檢測熒光信號為陰性的微滴比例,可以通過泊松分布求出靶基因拷貝的絕對濃度,不需要依賴參考曲線。對于高濃度的樣品,需要事先進行稀釋,將λ數值置入適合置信區間的泊松分布定量范圍(0.0001-6),這樣才能獲得可靠的實驗結果。
7. 數字PCR之間的比較

圖7. 商業dPCR系統。 (A,B)芯片式數字PCR系統。 (A)Fluidigm BioMark系統,包括(A左)芯片,(A右上)BioMark HD循環儀,(A右下)EP1閱讀器和(未示出)IFC控制器。(A中):來自基因表達研究的熒光圖像。 (B)Thermo Fisher Quantstudio 3D,包括(B左)帶有20,000個腔室的開放式芯片,(B右)檢測系統和(未顯示)熱循環儀。 (C-E)微滴式數字PCR系統。 (C)Bio-Rad QX100 / 200,包括(C左)液滴生成芯片,(C中)液滴檢測系統以及相應的儀器。(C右):拷貝數變異研究中的兩通道散點圖。(D)RainDrop系統,包括源芯片和傳感芯片以及它們各自的儀器。(D左下):突變檢測中擴增后的兩個彩色熒光液滴。D右:來自突變檢測的典型兩通道散點圖。(E)Stilla Naica系統,包括(E左)Sapphire芯片和(E中)Naica Geode液滴發生器/熱循環儀,以及(E右上)Naica Prism3檢測系統。(E右下):擴增后的三色熒光滴。
目前的商品化數字PCR系統主要分為兩大類:1.芯片式數字PCR(cdPCR),2.微滴式數字PCR(ddPCR)。芯片式數字PCR代表型號包括:Fluidigm公式的BioMark系統,Thermo Fisher公式的Quantstudio 3D系統。微滴式數字PCR代表型號包括:RainDance公司的RainDrop系統(2017年被收購,目前已經推出市場),Bio-red公司的QX100 / 200系統,以及Stilla公司的Naica系統。相關參數的對比見下表:
項目 | 熒光定量PCR | 芯片式PCR | 微滴式PCR | ||
儀器型號 | —— | Quantstudio 3D | BioMark qdPCR 37K | Bio-Rad QX200 | Stilla Naica |
分區數量 | —— | 2萬 | 48x770 | 1.5萬-2萬 | 3萬 |
分區體積 | —— | 0.72nL | 0.85nL | 0.837nL | 0.59nL |
線性范圍 | 9 log | 5 log | 2 log | 5 log | 5 log |
樣品體積 | 0.03-200μL | 14.4μL | 4μL | 20μL | 25μL |
檢測靈敏度 | 1-2 copies | 7-8 copies | 4-5 copies | 5-6 copies | 1 copy |
檢測分辨率 | 1.5-2-fold | 1.2-fold | 1.2-fold | 1.2-fold | 1.2-fold |
多重檢測 | 2-6 colors | 2 colors | 2-5 colors | 2 colors | 3 colors |
精確度(95% CI) | 可變參數 | ±10% | NA | ±10% | ±10% |
單樣品支出 | $2/sample | $10/sample | $400/ship | $6/sample | $7/sample |
表1. 主流商品化數字PCR系統參數比較
很顯然,微滴式數字PCR系統可以更加經濟高效的在單一樣品產生更多的分區單元,增加的分區數量的好處如將所述:第一,顯著降低檢測限,樣品濃度非常低的時候依然能進行有效檢測;第二,產生富集效應,在相似的核酸背景中檢測稀有靶標能力,這有助于檢測野生型群體中的單核苷酸多態性(SNP)和其他稀有等位基因,例如循環腫瘤DNA(ctDNA);第三,增加動態范圍,因此無需稀釋即可容納更大范圍的樣品。Stilla公司的Naica系統是目前主流商品化數字PCR系統中有效微滴數量最多的系統,檢測范圍更寬,分辨率更高,數據更為精準。
熒光通道的數量決定數字PCR系統在同一個樣品中檢測復數靶標的能力,Stilla公司的Naica系統是唯一提供3色熒光通道的數字PCR系統。目前熒光定量檢測試劑盒多為3色試劑盒(例如新型冠狀病毒ORF1ab、N、E三個基因靶標試劑盒),數字PCR的檢測也會朝著這個方向進行發展。

可以看出Stilla公司的Naica系統在多個系統的比較中,是微滴生成數量最多的系統,也是唯一一個具有3重熒光通道的數字PCR,能夠在同一個樣品中同時進行3個基因靶標的檢測。除此以外,Naica系統操作簡單,反應快速,2.5小時內即可獲得檢測結果,也是市面上唯一一款具備微滴回溯和質控功能的數字PCR系統,完全區別于同類產品。Naica數字PCR系統支持廣泛的基因檢測和分子生物學分析,包括用于癌癥診斷的液體活檢研究、病毒載量檢測、產前篩查和轉基因成分檢測等,是精準治療中用藥組合和療效監測的首選技術。